Notícias Recentes
Em busca de remédios para covid-19, UE pode vender remdesivir antes de EUA

Representante da União Europeia informou que a autorização provisória para a comercialização do remdesivir pode ser emitida nos próximos dias

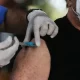
Remdesivir: sem tratamento para covid-19, a demanda pelo remédio vem crescendo (Ulrich Perrey/Reuters)
A União Europeia pode dar uma autorização inicial para a venda do remédio remdesivir como tratamento da Covid-19 nos próximos dias, disse o chefe de sua agência de medicamentos nesta segunda-feira, apressando a chegada do produto ao mercado em meio a uma competição global acirrada por recursos.
Os Estados Unidos, que revoltaram a UE com táticas agressivas em uma disputa por remédios em meio à pandemia global, ainda não emitiram uma aprovação semelhante ao medicamento, fabricado pela empresa farmacêutica norte-americana Gilead.
A demanda de remdesivir vem crescendo, já que atualmente não existem tratamentos ou vacinas para a Covid-19, a doença respiratória causada pelo novo coronavírus.
“Pode ser que uma autorização provisória de comercialização seja emitida nos próximos dias”, disse o chefe da agência de medicamentos do bloco, Guido Rasi, nesta segunda-feira em uma audiência no Parlamento Europeu em Bruxelas.
Uma autorização provisória de comercialização para a UE permite que um remédio seja vendido durante um ano no bloco de 27 nações antes de todos os dados necessários sobre sua eficiência e seus efeitos colaterais estarem disponíveis.
A Agência Europeia de Medicamentos (EMA) já recomendou o uso compassivo de remdesivir, o que permite que este seja administrado a pacientes mesmo antes de a venda ser autorizada.
A recomendação da EMA sobre o uso compassivo equivaleu a uma autorização de emergência concedida pela Agência de Alimentos e Medicamentos dos EUA (FDA) no início de maio depois que a Gilead forneceu dados mostrando que o remédio ajudou pacientes com Covid-19.
Mas agora a UE está agindo rápido para passar à próxima fase do procedimento de autorização.
O procedimento equivalente dos EUA é chamado de “aprovação acelerada”, o contrário da autorização padrão que a FDA concede a remédios que passam em todos os testes antes da comercialização.
Em meio à pressão crescente para intensificar a produção do medicamento, a Gilead disse que está conversando com fabricantes de produtos químicos e remédios para produzir remdesivir para Europa e Ásia ao menos até 2022.
Mas ainda não está claro com que rapidez quantidades suficientes do remédio podem estar disponíveis para atender a necessidade mundial de um tratamento.












Você precisa estar logado para postar um comentário Login